В былые времена большинство людей не сталкивалось ни с чем сложнее воды, дров и еды. Когда в руки попадала заморская вещица - брусок "made in Syria" из непонятной "фигни", образующей пену в воде при трении, то его назвали просто мылом, потому что оно моет, а из чего сделано... Бог весть... Сирийским мылом на основе масел лаврового листа и оливкового пользовались ещё египетские фараоны, стоило оно дорого, было предметом роскоши. Много веков спустя французам удалось импортозамещение, но уже без лавра - так появилось марсельское мыло...
В наши дни даже самый недалёкий вынужден слышать, читать и употреблять продукты высокой химии со сложными названиями, но запомнить их не может, поэтому выбирает "самое главное" (по его мнению). Химика или гораздо более подкованного в теме человека такие сокращения сильно удивят, но можно брюзжать "за жизнь вообще", а можно докопаться до сути вопроса.
Ртуть (Hg)- химический элемент, иногда встречающийся в чистом виде, но обычно вступающий в различные соединения. Видимо, это и есть "элементарная р.".
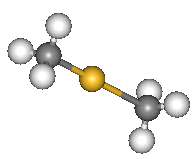
Химические соединения, в которых содержится углерод (C), относят к органическим. Существуют такие и с участием атомов ртути. Их называют ртутьорганическим<wbr />и соединениями. Главная "фишка": Hg должна быть непосредственно связана с C. Если кому-то лень писать и выговаривать длинный термин, то он скажет "органическая р.", хотя её вовсе не выращивают на огороде без пестицидов и антибиотиков, как требуют правила "органического земледелия" (это термин из совсем другой области). Например, диэтилртуть - один из самых известных нейротоксинов. А ещё есть и диметилртуть. На её схеме ниже жёлтый шарик - атом ртути, серые - атомы углерода, белые - атомы водорода (H). Привожу её, потому что здесь наглядно видно, что делает ртуть "органической".
- Все другие соединения ртути относятся к неограническим. Они считаются чуть менее ядовитыми, чем ртутьорганические, но их предельно допустимое количество для человека тоже сильно ограничено. Самый известный представитель - минерал киноварь, в котором ртуть соединена с серой.
Словом, если Вам когда-то попадётся "ртуть с эпитетом", то речь идёт вовсе не о её "сортах", а о сложных веществах, в составе которого есть и этот элемент. И сразу же скажу, что никакой "красной р." никогда не было, это вещество из того же семейства, что и снежный человек.
Зачем? Чтобы выставить об этом ролик на Ютьюбе и набрать много ездовых лайков. Видать, ему не давали покоя лавры сталевара, который на рабочем месте и так и сяк трогал руками расплавленную сталь. Но не все жидкие металлы можно трогать безнаказанно!
Пишут, что принимать ртуть внутрь - не смертельно и не так разрушительно, как дышать ее парами. Но вообще-то ей и в пищеварительном тракте не место.
Может, этот директор надышался парами ртути на рабочем месте, немного повредился в рассудке и решил, что он теперь градусник? Интересно, он не боится разбиться, а по ночам не укладывается в плотный футляр?
Есть разные методы качественного и количественного определения паров ртути в воздухе. Есть чисто химические методы (воздух прокачивают через трубку с активированным углем, потом его из трубки извлекают, ртуть вымывают азотной кислотой, а потом уже используют характерные реакции на ртуть). Но это долго. Быстро содержание ртути в воздухе определяют физическим методом, с помощью портативного прибора. Известно, что электрический разряд в разреженных парах ртути возбуждает атомы ртути, которые излучают жесткий ультрафиолет с длиной волны 253,7 нм. Соответственно невозбужденные атомы ртути такое излучение поглощают. На этом и основано действие прибора. В нем есть маленькая ртутная лампочка и детектор, измеряющий степень поглощения излучаемого света воздухом. Чем больше в нем концентрация паров ртути, тем сильнее поглощение.
Чувствительность прибора очень высокая, он может измерить тысячные доли миллиграмма в литре воздуха.
Вот как выглядит один из анализаторов ртути в воздухе - LIGHT-915.
Если обнаружена ртуть, проводят демеркуризацию. Например, разбрызгивая раствор, содержащий йод (он со ртутью образует нерастворимый дииодид).
Ртуть присутствует во всём человеческом организме. В биологических концентрациях – 13 мг.
Дихлорид ртути(сулема) участвует в обеспечении жизнеспособности клеток и способствует устранению неблагоприятных изменений обмена веществ, возникающих практически при любой патологии: в микродозах активирует ферменты, регулирующие процессы биологического окисления, и этим увеличивает уровень обеспечения организма кислородом и энергией.
Признаки недостаточности ртути: частые простудные заболевания, множественные воспалительные процессы.
Восполнять недостаток ртути безопасно ТОЛЬКО через пищевые источники ртути: морская рыба и другие морепродукты, рис, морковь, салат–латук.
ВАЖНО!
В сутки человеку нужно около 1 мкг! 0,4 мг - уже серьёзная токсическая доза!
Токсичность ртути зависит от её химической формы. Жидкая не так опасна, как испарившаяся. В организм человека ртуть обычно попадает через легкие или желудочно-кишечный тракт. Соединения ртути хорошо растворяются в липидах, поэтому легко проникают через альвеолярную мембрану, стенку кишечника, плацентарный барьер, кожу. Вызывает нарушения деятельности нервной системы и пищеварительного тракта, дерматозы.
Дело в том, что не всякая шерсть валяется. Хорошо валяется бобровый подшерсток, но бобры были в дефиците. Хорошо валяется и овечья шерсть, но она слишком груба для шляп. У той и у другой на волосках есть зазубрины. А вот у кроличьей шерсти, раздобыть которую не было проблем в Англии, таких зазубрин нет, и поэтому она не валяется. Обработка такой шерсти раствором нитрата ртути меняет ее свойства и она начинает хорошо валяться.